La revolución de los intestinos
El conjunto de microorganismos que viven en nuestro cuerpo actúan como una barrera protectora contra patógenos externos, potencian el sistema inmune y ayudan a metabolizar alimentos. Donar materia fecal podría ser tan importante en un futuro próximo como donar sangre. ¿Quién controlará la calidad y la seguridad de ese proceso? El gastroenterólogo del Hospital de Clínicas, Carlos Waldbaum
Para comprender un hallazgo científico, muchas veces se necesita una idea potente que sintetice lo nuevo. Y así, bajo este concepto potente de que somos mitad humanos y mitad bacterias, se abre paso la microbiota o el conjunto de microorganismos necesarios que viven en nuestro cuerpo.
:quality(85)/cloudfront-us-east-1.images.arcpublishing.com/infobae/26OVN4SSHVCU5GIDUSVDI5PAUE.jpg)
Millones de bacterias, hongos y virus habitan en nuestro organismo y la ciencia tiene en claro que son microorganismos determinantes para protegernos de enfermedades y pestes a las que nos enfrentaremos a lo largo de la vida.
La microbiota y/o materia fecal se encuentra en el intestino e influye decididamente en la salud, el metabolismo y el sistema inmunitario. Cada vez más estudios demuestran la importancia de tener una microbiota (materia fecal) equilibrada y diversa, y cómo, por el contrario, los desajustes pueden provocar enfermedades como obesidad, diabetes, alergias, depresión o cáncer. Hay una serie de factores que modifican la microbiota y qué se deberían tener en cuenta para evitar la pérdida de la diversidad bacteriana CREDIT: Quanyin Hu
Hay una serie de factores que modifican la microbiota y qué se deberían tener en cuenta para evitar la pérdida de la diversidad bacteriana CREDIT: Quanyin Hu
Queda claro, entonces, por qué el rol de la microbiota y/o materia fecal actuará como una barrera protectora contra los patógenos externos; a la vez que equilibrará el sistema inmune y ayudará a metabolizar los alimentos.
La materia fecal (microbiota) se convierte así en una materia prima esencial para el organismo; y tendrá picos para el ser humano: el sumun vendrá al nacer del canal vaginal y del aporte de la lactancia materna; y la declinación con la vejez.
En la actualidad al intestino se lo denomina “segundo cerebro”. Y se lo nomina así debido a la extensa red de neuronas y neurotransmisores presentes, conocidos como sistema nervioso entérico (ENS, por sus siglas en inglés), que es autónomo y controla directamente el aparato digestivo con sus propios circuitos neuronales. Si bien el intestino y su microbiota funcionan independientemente del sistema nervioso central; se comunican con él a través de los sistemas simpático y parasimpático.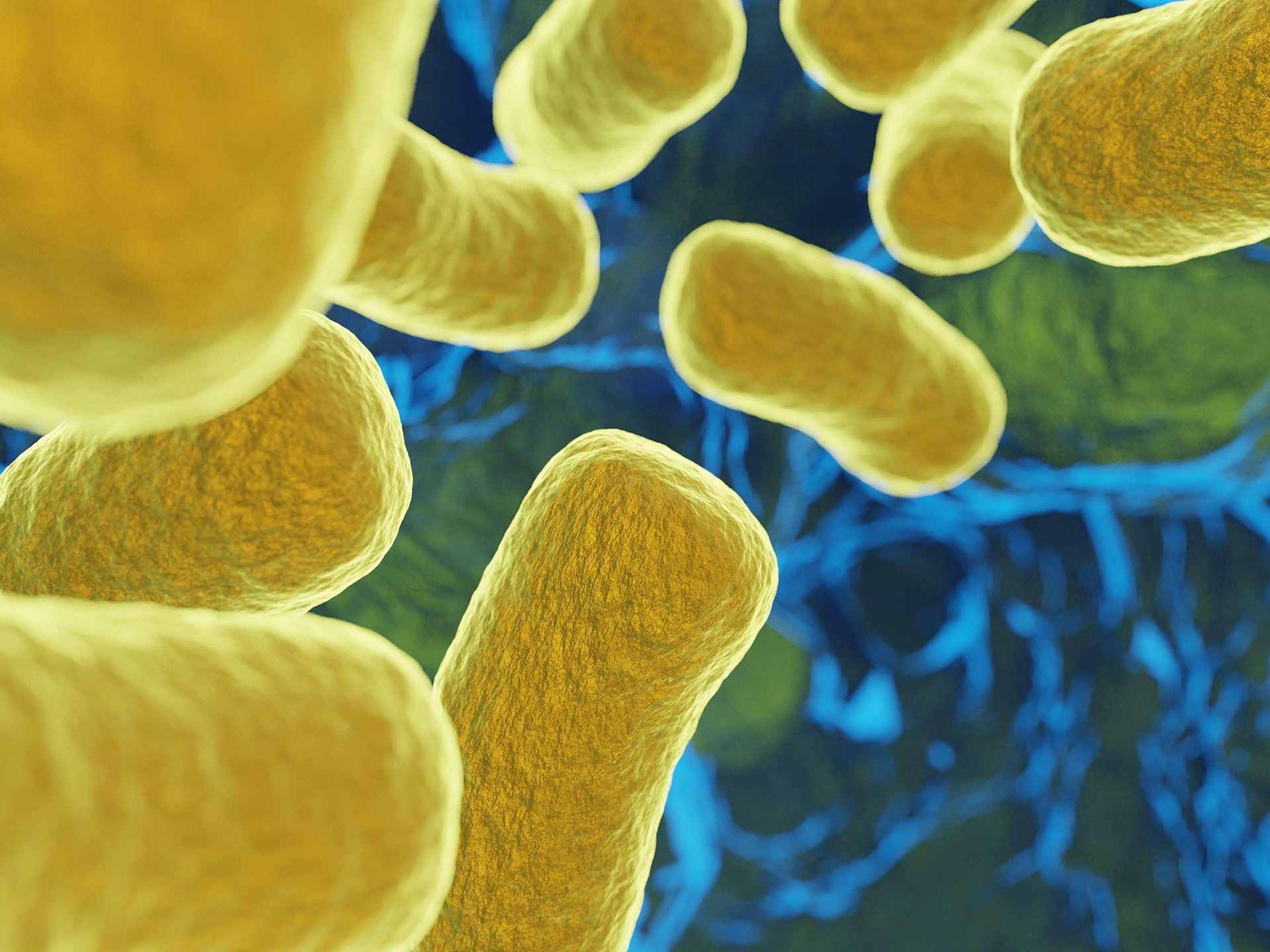 Primer plano de la bacteria Clostridium Difficile (CD) que evidenció ser resistente a los antibióticos: provoca infecciones intrahospitalarias severas (puede llevar a la muerte); responsable de una alta proporción de las diarreas asociadas a los antibióticos. Según los expertos, el trasplante de microbiota fecal es más eficaz que los antibióticos en el tratamiento de las infecciones recurrentes por CD. (Grosbygroup)
Primer plano de la bacteria Clostridium Difficile (CD) que evidenció ser resistente a los antibióticos: provoca infecciones intrahospitalarias severas (puede llevar a la muerte); responsable de una alta proporción de las diarreas asociadas a los antibióticos. Según los expertos, el trasplante de microbiota fecal es más eficaz que los antibióticos en el tratamiento de las infecciones recurrentes por CD. (Grosbygroup)
Segundo cerebro en acción
La mayor parte de la microbiota se encuentra en el intestino e influye en la salud, metabolismo y sistema inmunitario. Ahora bien, ¿cómo podemos mejorar la calidad de nuestra microbiota? ¿Qué posibilidades tenemos para restaurarla cuando está dañada? Una de las opciones más prometedoras es el trasplante de microbiota o materia fecal que consiste en transferir heces de un donante sano a un receptor que tiene una microbiota alterada.
Este procedimiento ha demostrado seguridad y eficacia para tratar infecciones intrahospitalarias como la que provoca la bacteria Clostridium difficile, que causa diarrea severa y que es resistente a los antibióticos, pudiendo generar un cuadro de grave a severo.
El trasplante de microbiota o materia fecal hoy plantea varios desafíos para el sistema de salud. ¿Quién puede ser donante? ¿Quién puede ser receptor? ¿Quién controla y guarda la calidad y la seguridad de las heces? ¿Quién será el administrador de estos tratamientos? ¿Tendrá la microbiota estatus de fluido esencial como la donación de sangre? ¿ O se convertirá en un medicamento producido por la industria farmacéutica? Aún no hay respuestas definitivas para estas preguntas.
La microbiota además tiene un papel esencial en la producción de neurotransmisores y hormonas, así como en la conexión con el cerebro a través del nervio vago. Existe una estrecha relación entre la microbiota intestinal y el cerebro, afectando la motilidad intestinal y la fisiología digestiva. Y los problemas en la microbiota pueden estar asociados con trastornos como la depresión y enfermedades degenerativas. Enfermedades inmunes que afectan al sistema nervioso, como la esclerosis múltiple, también están vinculadas a la microbiota. El intestino es el segundo cerebro, debido a la extensa red de neuronas y neurotransmisores presentes, conocidos como sistema nervioso entérico (Nicoletta Barolini)
El intestino es el segundo cerebro, debido a la extensa red de neuronas y neurotransmisores presentes, conocidos como sistema nervioso entérico (Nicoletta Barolini)
La idea del trasplante
El trasplante de microbiota o materia fecal es una opción terapéutica para pacientes que necesitan reestablecer el equilibrio de su microbiota intestinal afectada por diversas enfermedades.
Se trata del tratamiento conocido como Trasplante de Microbiota o Trasplante Fecal (TMF), que consiste en transferir al intestino de un paciente las bacterias beneficiosas que viven en el intestino de un donante sano. Si bien su aplicación está en marcha en muchos lugares del mundo, incluida Argentina, el debate está abierto porque aún no está claro si estas terapéuticas quedarán en manos de los laboratorios, a través del desarrollo de fármacos, o de los hospitales a través de bancos, por medio de la práctica médica, por vía endoscópica o colonoscópica.
Hay que señalar que la idea del trasplante de microbiota no es nuevo. Lo es para la ciencia occidental, que comenzó con estas investigaciones a mediados del siglo XX.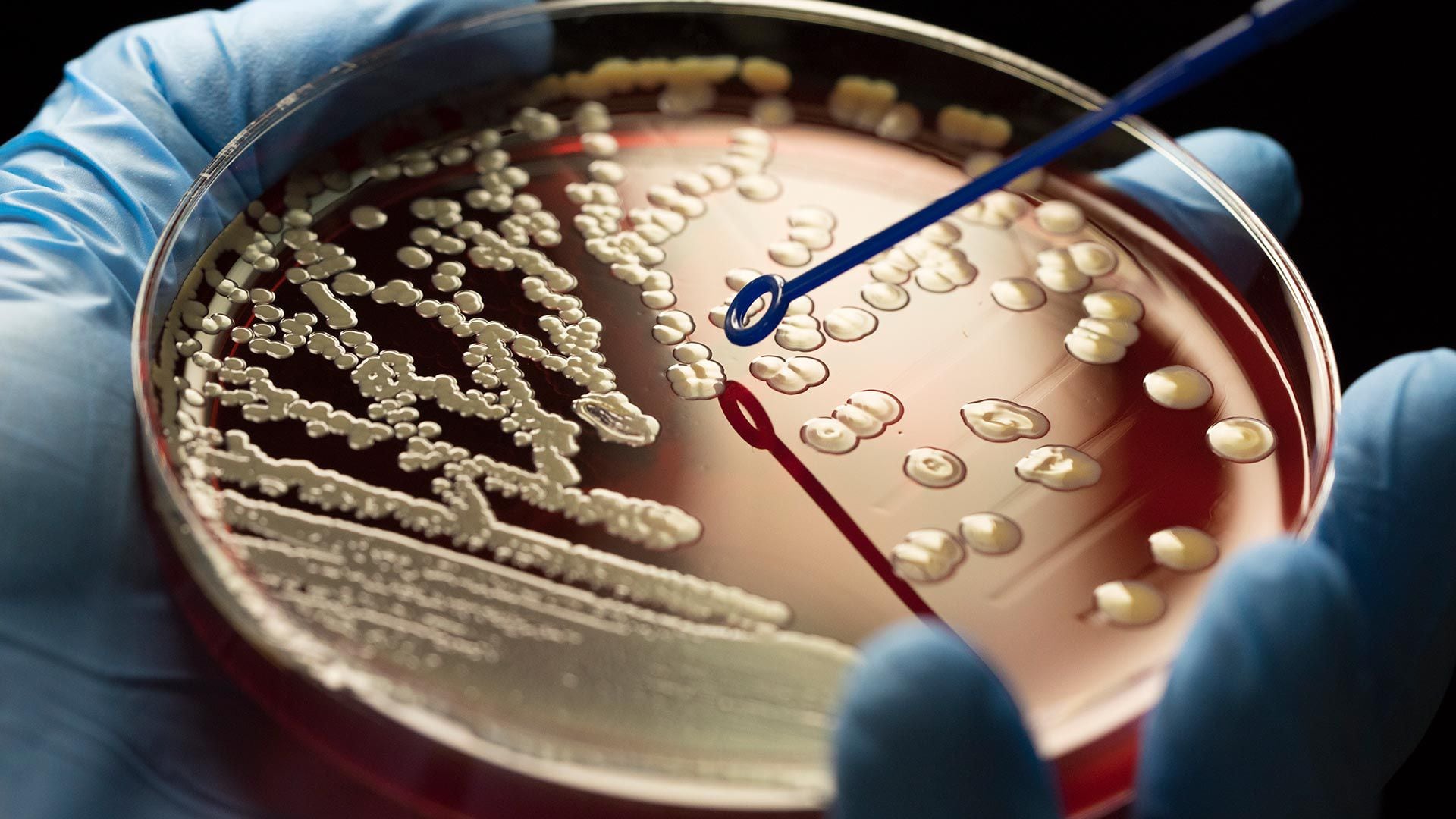 La Organización Mundial de la Salud (OMS) catalogó a la resistencia antimicrobiana (RAM) como una de las 10 principales amenazas frente a las que se encuentra la humanidad. (Gettyimages)
La Organización Mundial de la Salud (OMS) catalogó a la resistencia antimicrobiana (RAM) como una de las 10 principales amenazas frente a las que se encuentra la humanidad. (Gettyimages)
Se trata de la sofisticación de un método y un conocimiento de la medicina china que data del siglo IV de esta era. Pero fue recién en 1958 que se llevó a cabo la primera prueba en forma de enema fecal. Recién 45 años más tarde, en 2013, se publicaron los resultados del primer ensayo clínico sobre esta técnica, que demostró que era más eficaz que los antibióticos en el tratamiento de las infecciones recurrentes por Clostridium difficile, la bacteria responsable de una alta proporción de las diarreas asociadas a los antibióticos. Las pruebas se aceleraron de forma abrumadora y tremendamente exitosa en los últimos 15 años.
Consultado por Infobae Carlos Waldbaum, gastroenterólogo (MN 55375), médico de planta de la División Gastroenterología del Hospital de Clínicas explicó: “En nuestro intestino habitan millones de bacterias, virus, hongos, y otros seres vivos, que adquirimos a lo largo de nuestras vidas. Ellos, a cambio de que les demos alojamiento y alimento, desarrollan para nosotros funciones esenciales tanto en la nutrición y la inmunidad, como así también en la síntesis de algunas vitaminas. Es decir, nos proveen de algunas soluciones que nosotros no podemos resolver”.
Waldbaum es además miembro del Programa de microbiota intestinal y del Banco de Microbiota del Hospital de Clínicas dependiente de la Universidad de Buenos Aires, lo que lo convierte en el experto número uno en la Argentina sobre el tema. “Esa comunidad microbiana (microbiota) —continuó—, es diversa y adquirida desde la infancia. Cuando está alterada pueden generarse enfermedades, y también muchas enfermedades se acompañan de esa pérdida de diversidad”.
Hábitos saludables
 El experto indicó que la lactancia materna es uno de los grandes aportes a la microbiota intestinal, por eso, cuando se reemplaza por leche maternizada, la microbiota es otra Getty
El experto indicó que la lactancia materna es uno de los grandes aportes a la microbiota intestinal, por eso, cuando se reemplaza por leche maternizada, la microbiota es otra Getty
Una dieta rica en fibra y alimentos fermentados pueden mejorar la calidad de la microbiota y fortalecer el sistema inmunológico. Hay que comprender que la microbiota se forma desde la vida intrauterina, influenciada por la salud y nutrición de la madre y la lactancia materna.
El trasplante de microbiota se utiliza para tratar infecciones graves y la resistencia antimicrobiana (RAM). Hay investigaciones en curso sobre el trasplante de microbiota como un enfoque terapéutico para diversas enfermedades. Por eso, en el futuro, se espera que los bancos de microbiota sean tan comunes como los de sangre en los hospitales, aunque aún hay debates sobre su regulación y quienes serán los participantes necesarios en el proceso.
La Organización Mundial de la Salud (OMS) catalogó a la resistencia antimicrobiana (RAM) como una de las 10 principales amenazas frente a las que se encuentra la humanidad. Se trata de un proceso por el cual las bacterias, virus, hongos y parásitos se vuelven resistentes a los antibióticos, antivirales y antifúngicos de uso frecuente, por lo que estos pierden efectividad para combatirlos. En 2013, se publicaron los resultados del primer ensayo clínico sobre esta técnica, que demostró que era más eficaz que los antibióticos en el tratamiento de las infecciones recurrentes por Clostridium Difficile. Esta bacteria también provoca una de las infecciones nosocomiales más importantes, genera diarrea, y puede poner en peligro la vida del paciente.
En 2013, se publicaron los resultados del primer ensayo clínico sobre esta técnica, que demostró que era más eficaz que los antibióticos en el tratamiento de las infecciones recurrentes por Clostridium Difficile. Esta bacteria también provoca una de las infecciones nosocomiales más importantes, genera diarrea, y puede poner en peligro la vida del paciente.
Dónde se aplica el trasplante de microbiota
En la Argentina, el Hospital de Clínicas es la única institución del país -hasta el momento- que cuenta con un banco propio de microbiota o de heces y practica el TMF. Esta opción terapéutica se utiliza para tratar infecciones graves y la -cada vez más en ascenso- resistencia antimicrobiana.
Cuando Infobae le preguntó al experto Waldbaum sobre detalles de este tipo de trasplante, explicó que por ahora se está aplicando en casos de infección por Clostridium difficile. Esta bacteria “suele aparecer luego de realizar tratamientos con antibióticos, dado que éstos matan también a los gérmenes buenos que nos protegen de las infecciones. Es un ‘germen oportunista’ que ‘vive en nosotros’ y que, al detectar la pérdida de diversidad, encuentra la posibilidad de predominar. Es en ese momento que se generan sus posibilidades de daño, porque no compite con otros (microorganismos) por el espacio, por los alimentos, por los nutrientes y, de alguna manera, florece”, graficó el médico. Además, esta bacteria provoca una de las infecciones nosocomiales más importantes, ya que genera diarrea y puede poner en peligro la vida del paciente.
Ante estas dolencias, lo que se busca con esta terapia “es regenerar esa diversidad de la microbiota perdida, transfiriendo la microbiota de una persona sana a un paciente que tuvo una afección que se produjo por la pérdida de la diversidad en su microbiota intestinal”, detalló el doctor Waldbaum.
La persona con Clostridium difficile, “en general, tiene una respuesta relativa al tratamiento con antibiótico, pero como los pacientes suelen recaer varias veces después de tener un episodio, hoy en día está aceptado para tratar a quienes presentan una forma severa, que no responde al tratamiento. El trasplante de materia fecal es una alternativa que tiene una alta tasa de éxito: más de un 90%”, precisó Waldbaum.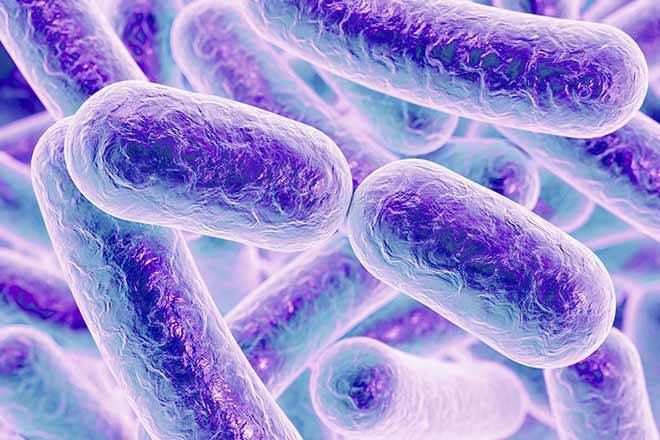 El desarrollo de estas terapias plantea varios desafíos éticos, legales y sociales, como quién puede ser donante, quién puede ser receptor, quién controla la calidad y la seguridad de las heces y quién se beneficia económicamente de este tratamiento
El desarrollo de estas terapias plantea varios desafíos éticos, legales y sociales, como quién puede ser donante, quién puede ser receptor, quién controla la calidad y la seguridad de las heces y quién se beneficia económicamente de este tratamiento
Cada vez más evidencia científica avala este tratamiento del trasplante TMF. Así, una investigación publicada recientemente, indicó que el trasplante de heces sería más eficaz para tratar la infección que los antibióticos. Jordi Guardiola, jefe del servicio de Aparato Digestivo del Hospital de Bellvitge de Barcelona y uno de los responsables de la Unidad para el Estudio del Microbioma de esa institución, advirtió en una entrevista reciente en El País, de España, que la infección por Clostridium difficile está “muy vinculada al uso de antibióticos. Produce una disbiosis profunda”, que es el desbalance del equilibrio microbiano de la microbiota.
Es una bacteria, dijo, “capaz de formar esporas que viven por todas partes y aguantan mucho tiempo. Seguramente hemos estado en contacto con ellas, pero a los adultos sanos no nos pasa nada. Al tomar antibiótico, sin embargo, se favorece la disbiosis y que las esporas germinen y, si ocurre ese desequilibrio, hay más riesgo de que la toxina produzca inflamación”.
Es decir, existe una paradoja aquí en torno del uso de antibióticos, señaló Guardiola, ya que “una enfermedad favorecida por antibióticos, la tratamos con más antibióticos: a la bacteria la matamos, pero provocamos más disbiosis y eso es lo que eleva el riesgo de recurrencia”. El rol de la microbiota: actúa como una barrera protectora contra los patógenos externos (Getty)
El rol de la microbiota: actúa como una barrera protectora contra los patógenos externos (Getty)
Cómo se practica el trasplante fecal
Waldbaum explicó que las heces de personas sanas son “procesadas en un laboratorio, centrifugadas, filtradas y se le extrae la microbiota, que se congela y se la guarda en el banco para que esté disponible para cuando un paciente requiera este tipo de transferencia”.
Posteriormente, el paciente recibe la microbiota o material fecal del donante por vía digestiva alta —por vía endoscópica a través de una sonda al intestino delgado— o por vía baja —a través de una colonoscopia—, o también es posible hacerlo de forma oral, ingiriendo cápsulas que contienen la microbiota congelada.
“Nosotros hicimos el primer trasplante hace más de seis años. Además, en el hospital de Clínicas contamos con un banco de microbiota y usamos este tratamiento para la infección por Clostridium difficile. Incluso, desarrollamos distintos protocolos de investigación donde estamos valorando el éxito posible de este tratamiento”, destacó el experto Carlos Waldbaum. El trasplante de microbiota fecal se puede realizar por vía endoscópica, colonoscópica o mediante cápsulas que contienen microbiota fecal liofilizada
El trasplante de microbiota fecal se puede realizar por vía endoscópica, colonoscópica o mediante cápsulas que contienen microbiota fecal liofilizada
Cuándo es eficaz el trasplante fecal
Los especialistas abocados a esta práctica médica afirman que se está demostrando, cada vez con más pruebas, su efectividad para determinadas afecciones. Así, Waldbaum advirtió que, “además de casos de infección por Clostridium difficile, el trasplante de heces se utiliza también en otras enfermedades y trastornos, y se investiga su efectividad en otras tantas afecciones”.
Indicó, asimismo, que es beneficioso en pacientes que recibieron un trasplante de médula ósea que, por lo general, presentan una microbiota profundamente alterada, ya sea por el estado nutricional en que se encuentran, por el uso de medicamentos como antibióticos durante mucho tiempo, por su enfermedad de base o por los efectos de los rayos o la quimioterapia. “El trasplante de microbiota fecal podría disminuir el rechazo del huésped [la persona trasplantada] cuando se manifiesta desde el punto de vista digestivo, y eso impactar, a la larga, en la sobrevida de estos pacientes”, planteó el médico del Hospital de Clínicas.
“Otras situaciones en las que estamos estudiando su impacto —continuó— es en la enfermedad inflamatoria intestinal. Tenemos un grupo chico de pacientes estudiados, pero está demostrado que tiene una tasa de respuesta bastante importante en pacientes que no responden a tratamientos de primera o segunda línea”. También, en personas con hepatitis alcohólica les ha permitido superar el episodio cuando no responden a tratamientos con fármacos habituales. Podría ayudar en más situaciones como “el Síndrome Metabólico, la respuesta a la inmunoterapia de algunos tumores, cuando algunos pacientes no responden a la quimioterapia de las drogas que actúan sobre la inmunidad. Aquí se vio que, al mejorar su microbiota, mejora su respuesta”, dijo. Y se observó que “en pacientes portadores de gérmenes resistentes a los antibióticos, el trasplante de microbiota intestinal puede tener un impacto positivo”. El trasplante de microbiota o heces tiene una efectividad superior al 90% para el tratamiento de la infección recurrente, unas cifras de curación poco habituales en medicina UNIVERSIDAD JUSTUS LIEBIG GIESSEN / KATRINA FRIESE
El trasplante de microbiota o heces tiene una efectividad superior al 90% para el tratamiento de la infección recurrente, unas cifras de curación poco habituales en medicina UNIVERSIDAD JUSTUS LIEBIG GIESSEN / KATRINA FRIESE
El trasplante de microbiota o heces tiene una efectividad superior al 90% para el tratamiento de la infección recurrente, unas cifras de curación poco habituales en medicina, muy superiores a las alcanzadas por tratamientos antibióticos repetidos, que no superan el 30-40%. El primer ensayo clínico aleatorizado que demostró de manera rotunda la eficacia de este procedimiento fue publicado en el New England Journal of Medicine y suspendido a la mitad, porque la superioridad mostrada por el TMF sobre los antibióticos era tal que no se consideró ético finalizar el reclutamiento previsto.
En estos términos, en la actualidad, no existen dudas acerca de que el tratamiento de elección de la infección recurrente por Clostridioides difficile es el TMF. Lamentablemente, solo una minoría de los pacientes con este problema acceden a esta terapeútica.
Cómo mejorar la microbiota
Hay una serie de factores que modifican la microbiota y qué se deberían tener en cuenta para evitar la pérdida de la diversidad bacteriana. “Esto está relacionado con nuestra historia de vida como un todo, por ejemplo, cómo nacemos, porque la primera adquisición es a través del parto vaginal, en cambio cuando se produce una cesárea se altera esta microbiota porque no se adquiere la que está en el canal vaginal de la madre, sino en la piel o en el sanatorio o en la institución donde se produjo la cesárea”, planteó. “De ahí que los chicos que nacen por cesárea tienen mayor frecuencia de alergias, asma y obesidad”, sostuvo. El intestino es el segundo cerebro, debido a la extensa red de neuronas y neurotransmisores presentes, conocidos como sistema nervioso entérico (Nicoletta Barolini)
El intestino es el segundo cerebro, debido a la extensa red de neuronas y neurotransmisores presentes, conocidos como sistema nervioso entérico (Nicoletta Barolini)
Y continuó: “También tiene un rol el tipo de lactancia, ya que la lactancia materna es uno de los grandes aportes a la microbiota intestinal, y cuando eso se pierde y se reemplaza por leche maternizada, la microbiota es otra”.
Además influyen en su composición nuestros hábitos, sobre todo los nutricionales y la frecuencia con la que tomamos medicamentos que interfieren o interactúan con la microbiota. “Por ejemplo, los inhibidores de la bomba de protones que se utilizan entre comidas como protectores gástricos. Éstos no son protectores universales, nos protegen de algunas cosas pero no de todas, y están muy difundidos como si fueran un protector para todas las situaciones, cosa que no es así”, explicó el gastroenterólogo del Hospital de Clínicas.
Luego, “hay otras situaciones, como las cirugías del aparato digestivo o incluso con la edad vamos perdiendo la riqueza de nuestra microbiota y en la vejez la microbiota se parece mucho a cuando éramos recién nacidos, cuando su diversidad es menor”, subrayó. Este trasplante consiste en transferir al intestino de un paciente las bacterias beneficiosas que viven en el intestino de un donante sano
Este trasplante consiste en transferir al intestino de un paciente las bacterias beneficiosas que viven en el intestino de un donante sano
Respecto de las pautas que las personas pueden adoptar para proteger su propia microbiota, aun en condiciones saludables, tal vez incorporando prebióticos y probióticos, Waldbaum dijo que lo importante es abordar el tema de la nutrición como un todo. “Esto es básico, porque con un probiótico nosotros, en teoría, aportamos alguna cepa, algún tipo de bacteria, pero eso no termina de incorporarse en forma definitiva a nuestra microbiota, así que los hábitos nutricionales son importantes a lo largo de toda la vida, y es un estímulo permanente para el desarrollo de nuestra microbiota”. Además, agregó que “los probióticos juegan un rol aleatorio y anecdótico en esa situación, pero el estilo de vida, incluyendo las características de la nutrición, juegan un rol fundamental”.
Por eso, su recomendación es una dieta equilibrada y variada, la cual contenga fibras, vegetales, hidratos de carbono y carnes, de forma sostenida. “Probablemente la dieta mediterránea sea la que más se acomoda al esquema”, afirmó. “La otra recomendación es incorporar encurtidos, que dan un aporte muy importante de algunas bacterias que necesitamos: el chucrut, la kombucha, los pepinos encurtidos, son un aporte nutricional importante de probióticos. Incorporarlos de forma alternada, saludable, satisfactoria, no como una militancia, sino tenerlos dentro de las opciones nutricionales”, sugirió.
Cómo donar
Finalmente, el doctor Waldbaum detalló cómo donar microbiota o heces. El banco del Hospital de Clínicas, dijo, es abastecido constantemente, pero siempre son bienvenidos los voluntarios. “Los donantes, una vez que sean chequeados y se detectan que son aptos, nos proveen de su materia fecal, que es procesada en un laboratorio”, indicó. Donar heces podría ser tan importante como donar sangre para mejorar la salud de muchas personas
Donar heces podría ser tan importante como donar sangre para mejorar la salud de muchas personas
“Es importante que la gente pueda contemplar la posibilidad de donar. Es sencillo, no le pedimos mucho: que sean sanos y se sometan a análisis de sangre de rutina y de materia fecal. Es más sencillo que donar sangre, porque no requiere nada salvo trasladar sus deposiciones en unas condiciones particulares que nosotros les proveemos para que sean procesadas”, detalló.
En este sentido, dio cuenta de los prejuicios que pueden llegar a operar: “Les pedimos que nos provean de su materia fecal, algo que pareciera que es terrible, que es desagradable, pero que genera un impacto en la calidad de vida de muchos pacientes que requieren de este novedoso tratamiento, entre comillas, porque es parte de la historia de la medicina, es ancestral”.
Al referirse a los prejuicios, el experto indicó que ocurre mucho menos en los pacientes que lo necesitan. “Está estudiado que los médicos creen que los pacientes van a sentir rechazo y la verdad que esto no es así y muchos, después de hacerlo, confirman que volverían a elegir el trasplante de microbiota”, afirmó.
Fuente: https://www.infobae.com/salud/ciencia/2023/08/15/del-trasplante-de-microbiota-a-los-bancos-de-materia-fecal-lo-ultimo-sobre-la-revolucion-de-los-intestinos/





